Что считать вакуумом?
Слово «вакуум» означает абсолютную пустоту, или пространство, свободное от вещества. Когда нет вещества, нечему и кипеть.
В науке и технике под ним понимают пространство, где давление значительно ниже атмосферного.
Критерием глубины вакуума является степень разрежения. Она определяется отношением давления в объеме к величине атмосферного. Единица измерения, принятая международной системой мер – Паскаль, но применяются и другие.
Нормальное атмосферное давление, измеренное на уровне моря, принято равным 760 мм ртутного столба, или 101325 Па. Например, разрежение, при котором давление равно 100 Па, считается низким, 0,00001 Па – высоким.
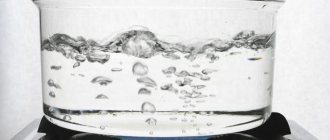
Как кипит H2O в таких условиях?
В любом сосуде, заполненном водой, всегда присутствуют частички воздуха. Они остаются на микроскопических трещинах, имеющихся на стенках емкости. По мере нагрева пузырьки увеличиваются, и становятся видимыми невооруженным взглядом, особенно на стенках сосуда и его дне. По сути, это капли насыщенного пара, растворенные в воде.
На определенном этапе пузырьки под действием силы Архимеда начинают выталкиваться наружу. Вода бурлит, но еще не кипит. Это связано с тем, что нагрев происходит неравномерно.
Когда температура на дне сосуда уже достигла 100 °C, а на поверхности воды ещё нет, сила поверхностного натяжения и атмосферное давление препятствуют выходу частиц за пределы емкости. Они возвращаются назад, теряя температуру.
Когда степень нагрева поверхностного и придонного слоя выравнивается, вещество закипает. В вакууме частицам легче покинуть объем сосуда. Этому препятствует только поверхностное натяжение, поэтому кипение начинается при более низкой температуре.
На данном уроке будет рассмотрена тема «Производные карбоновых кислот. Сложные эфиры». Благодаря этой теме, вы сможете познакомиться с производными карбоновых кислот. Также вы изучите самые важные функциональные производные карбоновых кислот – сложные эфиры. Рассмотрите их состав, некоторые свойства, формирование названий и сферы их применения в жизни.
I. Состав и строение сложных эфиров
Сложные эфиры – функциональные производные карбоновых кислот, в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-OR).
Сложные эфиры карбоновых кислот – соединения с общей формулой R–COOR’, где R и R’ – углеводородные радикалы.
II. Физические свойства и нахождение сложных эфиров в природе
- Летучие, бесцветные жидкости
- Плохо растворимы в воде
- Чаще с приятным запахом
- Легче воды
Сложные эфиры содержатся в цветах, фруктах, ягодах.
Они определяют их специфический запах. Являются составной частью эфирных масел (известно около 3000 эф.м. – апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH3(CH2)14–CO–O–(CH2)29CH3
| Аромат. Структурная формула. | Название сложного эфира |
| Яблоко | Этиловый эфир 2-метилбутановой кислоты |
| Вишня | Амиловый эфир муравьиной кислоты |
| Груша | Изоамиловый эфир уксусной кислоты |
| Ананас | Этиловый эфир масляной кислоты (этилбутират) |
| Банан | Изобутиловый эфир уксусной кислоты (у изоамилацетата так же напоминает запах банана) |
| Жасмин | Бензиловый эфир уксусной (бензилацетат) |
Запахи эфиров:
Рис. 1.
Сложные эфиры нерастворимы в воде, но хорошо смешиваются со многими органическими веществами. Именно поэтому они используются как растворители для лаков и красок. Рис. 1. Этилацетат и метил ацетат – основа растворителя – жидкости для снятия лака с ногтей.
Температуры кипения сложных эфиров меньше, чем температуры кипения кислот и спиртов с близкой молярной массой. Почему? Сложные эфиры, в отличие от кислот и спиртов, не способны образовывать водородные связи между молекулами.
Сравнение температуры кипения эфиров
III. Номенклатура сложных эфиров
Краткие названия сложных эфиров строятся по названию радикала (R’) в остатке спирта и названию группы RCOO- в остатке кислоты. Например, этиловый эфир уксусной кислоты CH3COOC2H5 называется этилацетат.
Названия по ИЮПАК выделены жирным шрифтом:
| H–COO–C2H5 | CH3–COO–CH3–CH3 | CH2CH2–COO–C2H5 |
| Этилформиат, этилметаноат; этиловый эфир муравьиной кислоты | Метилацетат, метилэтаноат; метиловый эфир уксусной кислоты | Этилбутират, этилбутаноат; этиловый эфир бутановой кислоты |
IV. Применение
- В качестве отдушек и усилителей запаха в пищевой и парфюмерной (изготовление мыла, духов, кремов) промышленности;
- В производстве пластмасс, резины в качестве пластификаторов.
Пластификаторы – вещества, которые вводят в состав полимерных материалов для придания (или повышения) эластичности и (или) пластичности при переработке и эксплуатации.
Применение в медицине
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
V. Получение сложных эфиров
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
Видео-опыт: «Получение уксусноэтилового эфира»
Видео-опыт: «Получение борноэтилового эфира»
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
RCOOR’ + H2O (H+)↔ RCOOH + R’OH
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
VI. Тренажеры
Тренажер №1: “Реакция этерификации”
ЦОРы
Видео-опыт: «Получение уксусноэтилового эфира»
Видео-опыт: «Получение борноэтилового эфира»
Почему может кипеть при отрицательных температурных значениях?
Когда среда разрежена, вода закипает раньше. Кипение начнется, как только разрежение достигнет величины, при которой температура кипения становится меньше температуры окружающей среды.
Ниже в таблице приведены округленные данные зависимости температуры кипения от давления.
| Давление, Pa | Температура кипения воды | ||
| °C | °F | °K | |
| 101 325 | 100 | 212 | 373 |
| 84 660 | 95 | 205 | 368 |
| 70 060 | 90 | 194 | 363 |
| 47 340 | 80 | 176 | 353 |
| 31 550 | 70 | 158 | 343 |
| 19 900 | 60 | 140 | 333 |
| 12 300 | 50 | 122 | 323 |
| 7 350 | 40 | 104 | 313 |
| 4 230 | 30 | 86 | 303 |
| 3 380 | 27 | 80 | 300 |
| 3 048 | 25 | 76 | 298 |
| 2 710 | 22 | 72 | 295 |
| 2 370 | 20 | 69 | 293 |
| 2 030 | 18 | 64 | 291 |
| 1 670 | 15 | 59 | 288 |
| 1 350 | 12 | 53 | 285 |
| 1 010 | 7 | 45 | 280 |
| 605 | 0 | 32 | 273 |
| 340 | -6 | 21 | 267 |
| 170 | -15 | 6 | 258 |
| 35 | -31 | -24 | 242 |
| 0,16 | -47 | -35 | 226 |
| 0,3 | -51 | -60 | 222 |
| 0,03 | -56 | -70 | 217 |
Вода, отдавая пар, остывает. Он конденсируется и возвращается обратно в жидкое состояние. При дальнейшей откачке воздуха разрежение становится таким, что H2O мгновенно вскипает.
Температура понижается до отрицательной, водяной пар кристаллизуется, образуя лед. Поскольку это сопровождается увеличением объема, образованию льда препятствует внешнее давление.
Чем оно меньше, тем раньше образуется лед. Поэтому, даже при низком разрежении вода неизбежно превратится в пар, затем в лед.
О различных температурных шкалах
История
Слово «температура» возникло в те времена, когда люди считали, что в более нагретых телах содержится большее количество особого вещества — теплорода, чем в менее нагретых. Поэтому температура воспринималась как крепость смеси вещества тела и теплорода. По этой причине единицы измерения крепости спиртных напитков и температуры называются одинаково — градусами.
Из того, что температура — это кинетическая энергия молекул, ясно, что наиболее естественно измерять её в энергетических единицах (т.е. в системе СИ в джоулях). Однако измерение температуры началось задолго до создания молекулярно-кинетической теории, поэтому практические шкалы измеряют температуру в условных единицах — градусах.
Шкала Кельвина
В термодинамике используется шкала Кельвина, в которой температура отсчитывается от абсолютного нуля (состояние, соответствующее минимальной теоретически возможной внутренней энергии тела), а один кельвин равен 1/273.16 расстояния от абсолютного нуля до тройной точки воды (состояния, при котором лёд, вода и водяной пар находятся в равновесии). Для пересчета кельвинов в энергетические единицы служит постоянная Больцмана. Используются также производные единицы: килокельвин, мегакельвин, милликельвин и т.д.
Шкала Цельсия
В быту используется шкала Цельсия, в которой за 0 принимают точку замерзания воды, а за 100° точку кипения воды при атмосферном давлении. Поскольку температура замерзания и кипения воды недостаточно хорошо определена, в настоящее время шкалу Цельсия определяют через шкалу Кельвина: градус Цельсия равен кельвину, абсолютный ноль принимается за −273,15 °C. Шкала Цельсия практически очень удобна, поскольку вода очень распространена на нашей планете и на ней основана наша жизнь. Ноль Цельсия — особая точка для метеорологии, поскольку замерзание атмосферной воды существенно всё меняет.
Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. В этой шкале на 100 градусов раздёлен интервал от температуры самой холодной зимы в городе, где жил Фаренгейт, до температуры человеческого тела. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а градус Фаренгейта равен 5/9 градуса Цельсия.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), то есть изменение температуры на 1 °F соответствует изменению на 5/9 °С. Предложена Г. Фаренгейтом в 1724.
Шкала Реомюра
Предложенна в 1730 году Р. А. Реомюром, который описал изобретённый им спиртовой термометр.
Единица — градус Реомюра (°R), 1 °R равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °R) и кипения воды (80 °R)
1 °R = 1,25 °C.
В настоящее время шкала вышла из употребления, дольше всего она сохранялась во Франции, на родине автора.
| Пересчёт температуры между основными шкалами | |||
| Кельвин | Цельсий | Фаренгейт | |
| Кельвин (K) | = K | = С + 273,15 | = (F + 459,67) / 1,8 |
| Цельсий (°C) | = K − 273,15 | = C | = (F − 32) / 1,8 |
| Фаренгейт (°F) | = K · 1,8 − 459,67 | = C · 1,8 + 32 | = F |
Сравнение температурных шкал
| Описание | Кельвин | Цельсий | Фаренгейт | Ньютон | Реомюр |
| Абсолютный ноль | 0 | −273.15 | −459.67 | −90.14 | −218.52 |
| Температура таяния смеси Фаренгейта (соли и льда в равных количествах) | 255.37 | −17.78 | 0 | −5.87 | −14.22 |
| Температура замерзания воды (нормальные условия) | 273.15 | 0 | 32 | 0 | 0 |
| Средняя температура человеческого тела¹ | 310.0 | 36.8 | 98.2 | 12.21 | 29.6 |
| Температура кипения воды (нормальные условия) | 373.15 | 100 | 212 | 33 | 80 |
| Температура поверхности Солнца | 5800 | 5526 | 9980 | 1823 | 4421 |
¹ Нормальная температура человеческого тела — 36.6 °C ±0.7 °C, или 98.2 °F ±1.3 °F. Приводимое обычно значение 98.6 °F — это точное преобразование в шкалу Фаренгейта принятого в Германии в XIX веке значения 37 °C. Поскольку это значение не входит в диапазон нормальной температуры по современным представлениям, можно говорить, что оно содержит избыточную (неверную) точность. Некоторые значения в этой таблице были округлены.
Сопоставление шкал Фаренгейта и Цельсия
(oF — шкала Фаренгейта, oC — шкала Цельсия)
| oF | oC | oF | oC | oF | oC | oF | oC |
| -459.67 -450 -400 -350 -300 -250 -200 -190 -180 -170 -160 -150 -140 -130 -120 -110 -100 -95 -90 -85 -80 -75 -70 -65 | -273.15 -267.8 -240.0 -212.2 -184.4 -156.7 -128.9 -123.3 -117.8 -112.2 -106.7 -101.1 -95.6 -90.0 -84.4 -78.9 -73.3 -70.6 -67.8 -65.0 -62.2 -59.4 -56.7 -53.9 | -60 -55 -50 -45 -40 -35 -30 -25 -20 -19 -18 -17 -16 -15 -14 -13 -12 -11 -10 -9 -8 -7 -6 -5 | -51.1 -48.3 -45.6 -42.8 -40.0 -37.2 -34.4 -31.7 -28.9 -28.3 -27.8 -27.2 -26.7 -26.1 -25.6 -25.0 -24.4 -23.9 -23.3 -22.8 -22.2 -21.7 -21.1 -20.6 | -4 -3 -2 -1 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 | -20.0 -19.4 -18.9 -18.3 -17.8 -17.2 -16.7 -16.1 -15.6 -15.0 -14.4 -13.9 -13.3 -12.8 -12.2 -11.7 -11.1 -10.6 -10.0 -9.4 -8.9 -8.3 -7.8 -7.2 | 20 21 22 23 24 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100 125 150 200 | -6.7 -6.1 -5.6 -5.0 -4.4 -3.9 -1.1 1.7 4.4 7.2 10.0 12.8 15.6 18.3 21.1 23.9 26.7 29.4 32.2 35.0 37.8 51.7 65.6 93.3 |
Для перевода градусов цельсия в кельвины необходимо пользоваться формулой T=t+T0 где T- температура в кельвинах, t- температура в градусах цельсия, T0=273.15 кельвина. По размеру градус Цельсия равен Кельвину.
Как быстро закипает?
Все зависит от степени разрежения. При недостаточной откачке воздуха холодная вода кипеть не будет.
Как только его станет меньше, она начнет переходить в паровую фазу.
Происходить это будет длительное время из-за конденсации. Теоретически можно достичь динамического равновесия, когда скорость испарения и скорость конденсации водяного пара равны.
При высоком разрежении закипание наступит практически мгновенно. Затем пар кристаллизируется из-за понижения температуры до отрицательного значения. Этот процесс тоже не займет много времени. Теплопроводность пара значительно выше, чем у воды, остывает он быстрее.